みなさま
総合内科ではCPPD(calcium pyrophosphate deposition diseases)をよく診療するので、
「CPPD」「review」とgoogleに入力したら
・NEJM2016の総説
・Clinical and Experimental Rheumatology2016の総説
・2011年のEULAR recommendation(古いですが)
がヒットしましたのでまとめておきます。
・NEJM2016の総説
・Clinical and Experimental Rheumatology2016の総説
・2011年のEULAR recommendation(古いですが)
がヒットしましたのでまとめておきます。
<用語の整理>
CPPDは臨床状況によって表現型が異なりますので、

・Asymptomatic CPPD:明らかな臨床的影響のないCPPD
・OA with CPPD:
・CPPD(過去には「pseudo-OA」)。
・Acute CPP crystal arthritis:
・Chronic CPP crystal arthritis:CPPDに関連する慢性炎症性関節炎(
ちなみに、痛風・
さらにちなむと、Daniel McCartyは自分と当時のフェローの膝に尿酸塩を注入して急
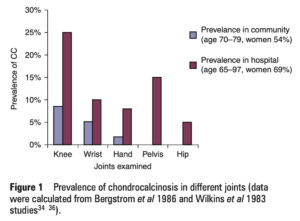
<頻度>
CPPDについては、推定値はさまざまですが、欧米の成人人口の
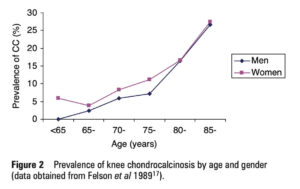
ただし、残念ながらCPPD疾患の有病率に関する現在の理解は、
しかもそのレントゲン所見である軟骨石灰化症は、
・臨床的に重大なCPPD疾患の患者の約40%しか同定できない
・関節破壊が進んだ重度の軟骨喪失の患者では、
ため、
・臨床的に重大なCPPD疾患の患者の約40%しか同定できない
・関節破壊が進んだ重度の軟骨喪失の患者では、
ため、
特に膝の線維軟骨における軟骨石灰化症は、
<偏光顕微鏡(自験例)と臨床症状>
関節穿刺液を偏光顕微鏡で観察すると、
・ピロリン酸カルシウム結晶
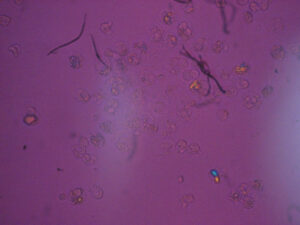
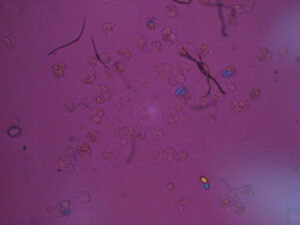
・痛風結晶
この偏光顕微鏡による色調変化は痛風でも起こりますが、
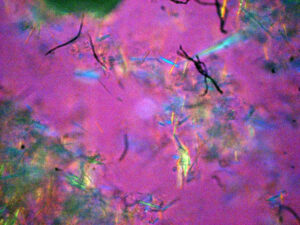
罹患関節は数多ありますが、基本的には膝、
 <病理学的イメージ>
<病理学的イメージ>イメージはNEJMの総説が一番綺麗です(N Engl J Med 2016;374:2575-84. )。
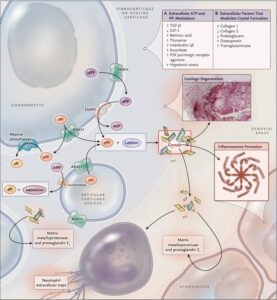
CPP結晶の形成は、関節軟骨の細胞周囲マトリックスで起こり、
ピロリン酸(PPi)は、細胞外ATPから生成され、
<リスク因子(Ann Rheum Dis . 2011 Apr;70(4):563-70.)>
CPPD疾患は明らかに老化の疾患であり、60歳未満の患者では
関節外傷もCPPDの強力な危険因子です。
また、いくつかの固有の疾患もリスク因子となり得ます。
・副甲状腺機能亢進症(高カルシウムを補正してもリスクは持続)
・低マグネシウム血症(特にGitteleman syndrome)
・ヘモクロマトーシス
・低ホスファターゼ血症(
あと、痛風の患者の5%にCPPDも合併します。
60歳未満であるにもかかわらずCPPDを発症する患者では、
・副甲状腺機能亢進症(高カルシウムを補正してもリスクは持続)
・低マグネシウム血症(特にGitteleman syndrome)
・ヘモクロマトーシス
・低ホスファターゼ血症(
あと、痛風の患者の5%にCPPDも合併します。
60歳未満であるにもかかわらずCPPDを発症する患者では、
ちなみに、
①染色体5pのCCAL2遺伝子座の変異(常染色体優性遺伝)→おそらく、ANKH(the human homolog of protein product of the murine progressive ankylosis gene)タンパク質の機能の獲得に起因します
②TNFRSF11B(オステオプロテゲリン)
①染色体5pのCCAL2遺伝子座の変異(常染色体優性遺伝)→おそらく、ANKH(the human homolog of protein product of the murine progressive ankylosis gene)タンパク質の機能の獲得に起因します
②TNFRSF11B(オステオプロテゲリン)
あと、Acute CPP crystal arthritisを起こすリスクとしては、急性疾患・
まずは以上です。次に治療をお送りします。
佐田 拝

